中美欧三个区域的药品注册机构毕竟有哪些?它们的注册流程又是何如规则的?这些流程之间又存正在着何如的差别呢?不绝阅读,带你一探毕竟!
国度药品监视统治局(NMPA)是中国药品囚禁的中心计构,其性能涵盖了药品(席卷中药、民族药)、医疗用具和化妆品的平安监视统治。NMPA不光担任拟定和监视奉行闭联法令法例、计谋计议以及部分规章,还担任探究造定唆使新技能新产物的统治与任职计谋。
正在结构架构上,NMPA设有归纳和计议财政司、计谋法例司、人事司、科技和国际互帮司(港澳台办公室)等归纳机构,以及药品监视统治司、药品注册统治司(中药民族药监视统治司)、医疗用具监视统治司、医疗用具注册统治司、化妆品监视统治司等生意机构。
NMPA的紧要使命席卷:担任药品、医疗用具和化妆品的圭表统治,结构拟定和通告国度药典等圭表;担任注册统治,拟定注册统治轨造,庄敬审评审批;担任质地统治,拟定研造和坐蓐质地统治范例并监视奉行;担任上市后危害统治,监测、评判和处分不良反映和不良事变;担任执业药师资历准入统治,依法查处违法活动;同时,NMPA还担任对应酬流与互帮,介入国际囚禁原则和圭表的拟定,并引导省、自治区、直辖市药品监视统治部分的就业。
省级药品监视统治部分正在药品注册方面,担任辖区内药品的监视统治就业,席卷贯彻奉行国度和省级药品监视统治法令法例,草拟闭联地方性法例、规章草案,拟定闭联计议、计谋并监视奉行。它们还担任药品的行政监视和技能监视,贯彻推广国度药典等药品圭表,以及药品研造、坐蓐、规划、应用质地统治范例。正在药品注册统治上,省级药监部分与NMPA协同就业,确保药品注册流程的利市实行。其它,省级药监部分还担任设备药品不良反映监测编造,发展监测和处分就业,以及实行国度基础药物目次,配合奉行国度基础药物轨造。
药品审评中央(CDE)是国度药品监视统治局的直属机构,其紧要职责是担任药品注册申请的审评就业。CDE的审评流程寻常席卷申请受理、原料审查、疏导换取、审评审批等症结。正在审评流程中,CDE会凭据闭联法例、计谋和技能恳求,对药品的平安性、有用性和质地可控性实行悉数评估。CDE的审评圭表庄敬服从国度药典等药品圭表,确保药品注册申请的科学性、范例性和公平性。
CDE的审评时限遵循分别类型的注册申请而有所分别。比方,关于新药注册申请,CDE必要正在规则的功夫内完毕审评就业,并给出是否答应的定夺。关于必要填充原料的申请,CDE会一次性示知申请人必要填充的实质,并正在收到填充原料后不绝审评。CDE还设有疏导换取机造,为申请人供应技能提倡,避免弯途,加快药物研发和上市进度。同时,CDE还担任药品注册检修和注册核查就业,确保药品注册申请的线 美国药品注册机构

FDA的中心构成局限席卷药月旦判与探究中央(CDER)、生物成月旦判与探究中央(CBER)、医疗用具与放射强健中央(CDRH)、食物平安与利用养分中央(CFSAN)、兽医学中央(CVM)以及烟草产物与尼古丁囚禁中央(CTP)等。FDA紧要担任囚禁美国国内坐蓐或进口的食物、化妆品、药物、生物造剂、医疗筑筑和放射产物

是FDA中担任药品审评的中心部分,旨正在确保新药的平安性和有用性。审评流程寻常席卷新药申请(NDA)的提交、审评打定、审评奉行和审评决议等阶段。正在审评流程中,CDER会归纳思索药品的临床试验数据、创造工艺、质地负责圭表以及标签和应用解说等讯息。审评标法规基于科学规矩、法例恳乞降大家优点等要素。CDER的审评时限因申请类型和庞大水准而异,但寻常会正在规则的功夫内完毕审评就业。假若药品切合平安性和有用性的圭表,CDER将向造药公司发表答应函,答应其正在美国墟市上发卖新药。

则专心于生物成品的囚禁就业,生物成品席卷疫苗、血液成品、基因调理产物等。CBER正在生物成品注册中的职责席卷审评生物成品的平安性、有用性和创造质地等方面。审评流程寻常席卷申请提交、原料审查、现场检验和审评决议等阶段。正在审评流程中,CBER会归纳思索生物成品的临床试验数据、创造工艺、质地负责圭表以及标签和应用解说等讯息。与CDER仿佛,CBER的审评圭表也基于科学规矩、法例恳乞降大家优点等要素。假若生物成品切合平安性和有用性的圭表,CBER将答应其上市发卖,并对其实行不断的囚禁和监测。

行动欧盟药品囚禁的中心计构,其的创造源于欧洲经济配合体(EEC)的闭联法例,自1995年起正式受理欧盟各成员国人用和兽用药品的上市申请。其总部位于荷兰阿姆斯特丹,前身为欧洲药月旦判局(EMEA),跟着英国脱欧而实行了燕徙。EMA的职责笼盖了欧盟周围内通盘药品的科学评判、监视统治和平安性监测,确保药品的平安、有用和高质地。
席卷一个统治委员会和多个科学委员会,统治委员会担任EMA的平日统治和决议,而科学委员会则专心于药品的科学评判和囚禁。实在来说,EMA下设有人用药品委员会(CHMP)、药物警备危害评判委员会(PRAC)、兽用药品委员会(CVMP)等多个科学委员会,它们永别担任分别周围的药月旦判和囚禁就业。其它,EMA还设有流程统治和贸易支撑部分、检验和药物警备部分等多个支撑性部分,以确保EMA可以高效、专业地实行其职责。
:通过科学评判和囚禁来保护和提升民多和动物的强健;庄敬对欧盟内的药品上市申请实行审评,确保药品的平安性和有用性;监测药品的平安,通过欧盟的平安监测或药物警备体系来不断性地评估药品的收益和危害平均;介入出格议题中的药品举荐秩序,处置闭于药品平安或收益危害平均的题目;担任奉行欧盟的长途讯息执掌项目,以及唆使药品的立异和研发等。
正在欧盟药品注册中,NCA与EMA严密互帮,配合确保药品的平安性和有用性。实在来说,NCA担任提交国度秩序的药品上市申请,实行药品平安监控,并推广GMP(优良坐蓐范例)、GCP(优良临床推行)等闭联检验。同时,NCA还介入EMA的科学委员会就业,为EMA供应科学提倡和帮帮。这种互帮机造确保了欧盟药品注册就业的利市实行,以及药品囚禁的划一性和高效性。
分散式注册是欧盟药品注册的两种紧要途径,主旨化注册秩序合用于特定的药品,如含有新活性因素的药品、用于重要疾病的药品、生物技能药品等。这些药品必要通过EMA实行集结审评,一朝取得上市许可,便可能正在通盘欧盟成员国上市。这种注册途径的上风正在于可以确保药品正在通盘欧盟周围内的速捷上市和联合囚禁。比拟之下,分散式注册秩序则愈加生动,合用于不正在主旨化注册周围内的药品。申请人可能采选向一个或多个成员国提交上市申请,由这些成员国的NCA实行审评。假若药品正在某个成员国取得上市许可,其他成员国正在审核后可能供认该定夺,并发表本国的上市许可。这种注册途径的上风正在于可以富裕愚弄各成员国的囚禁资源和专业学问,同时确保药品正在欧盟周围内的广大上市。
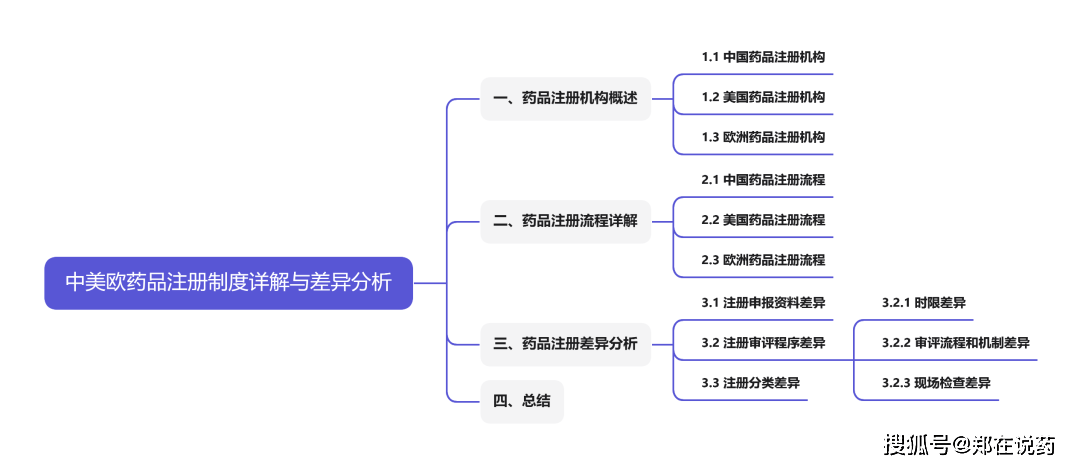
仿造药注册和进口药注册三大类,每一类都有其特定的恳乞降流程。新药注册流程涵盖了从临床前探究到临床探究,再到新药申请和审批的全流程。临床前探究是新药研发的开始阶段,紧要标的是评估药物的平安性、药代动力学特点以及开头的疗效。这一阶段席卷药物的合成、造剂探究、药效学探究、药代动力学探究、毒理学探究等。
I期临床试验紧要评估新药正在强健志向者中的平安性和耐受性,确定药物的开头平安剂量周围;II期临床试验正在患有特定疾病的患者中评估新药的有用性和平安性,进一步确定药物的疗效和最佳剂量;III期临床试验则进一步伸张患者样本量,验证新药的临床效益和平安性,并与现有疗法实行斗劲;IV期临床试验是新药上市后的监测阶段,旨正在评估新药正在实践应用中的永远平安性和疗效。
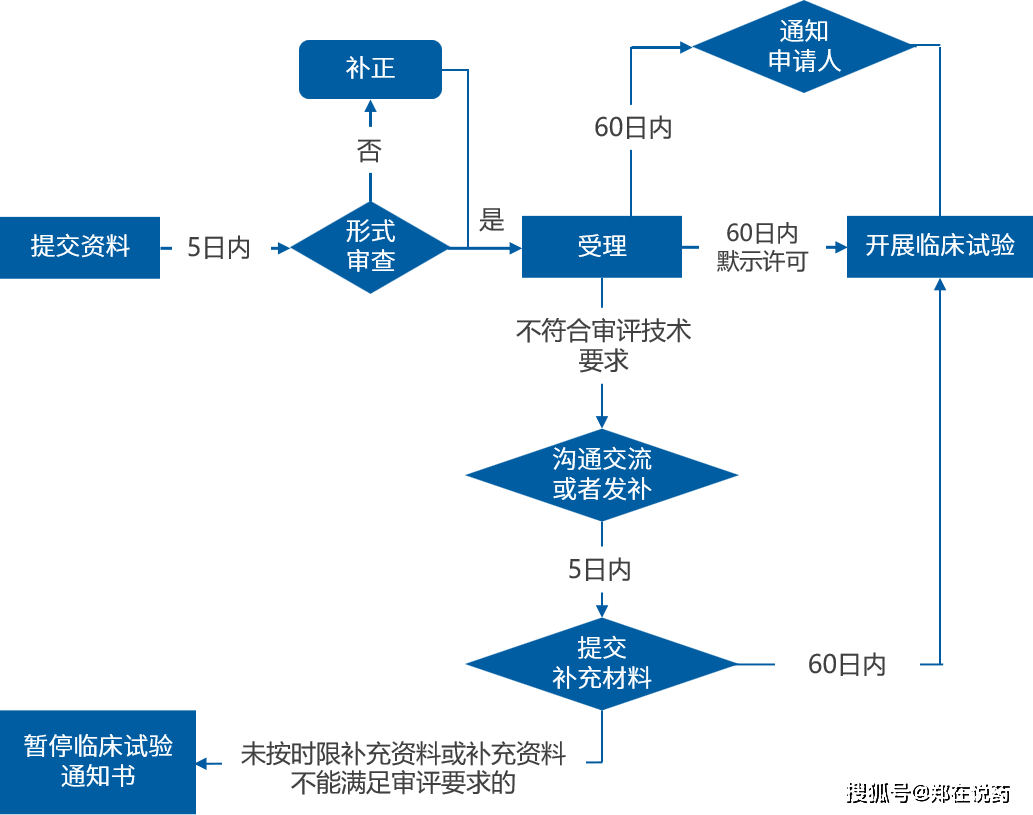
仿造药注册流程寻常席卷:企业提交仿造药注册申请,席卷仿造药的质地圭表、坐蓐工艺、褂讪性探究数据、BE试验数据等讯息。NMPA将对申请实行审评,席卷对仿造药的质地、平安性和生物等效性的评估。
正在审评流程中,NMPA会对申报原料确实实性、完备性和范例性实行审核,并恳求企业供应特殊的数据或讯息。假若进口药切合平安性和有用性的圭表,NMPA将发表进口药品注册证书,答应进口药正在中国墟市发卖。
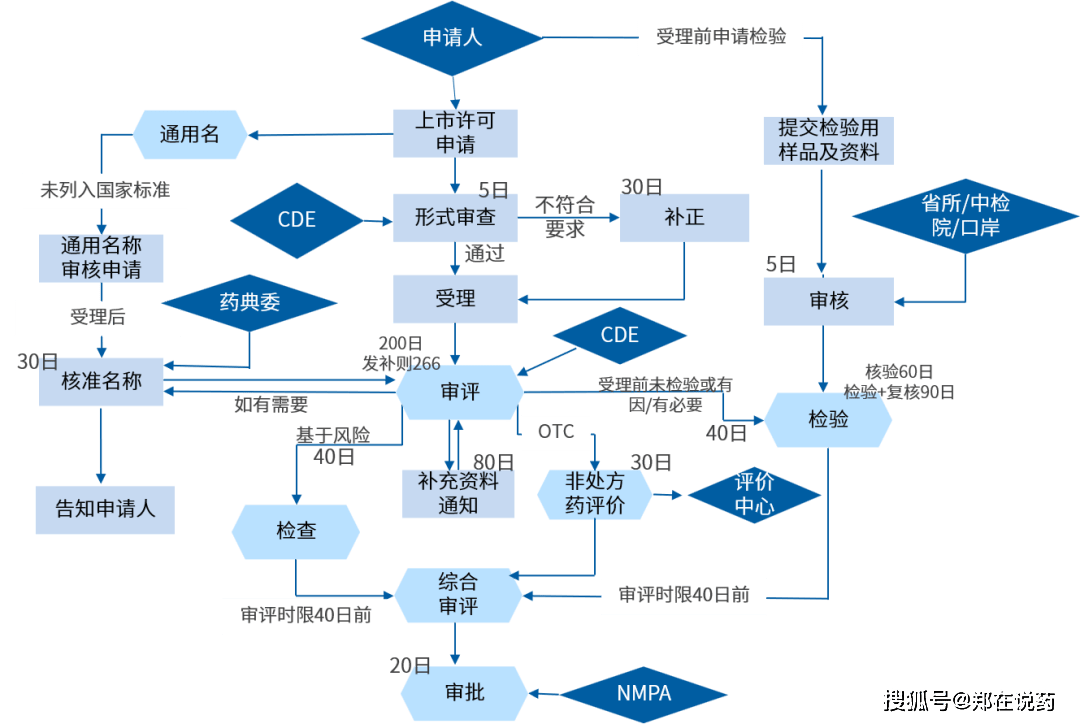
新药申请(NDA)、约略新药申请(ANDA)以及生物成品许可申请(BLA)等多个方面。NDA
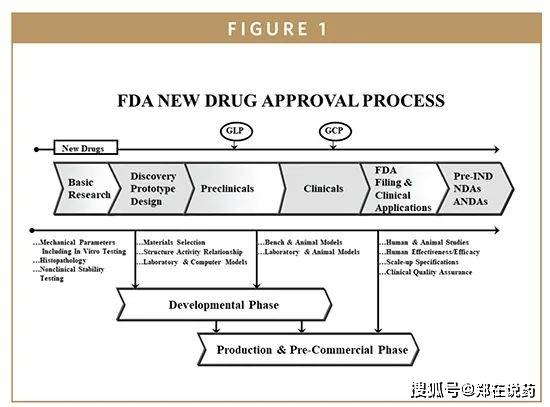
全新化学实体、新分子实体或明显更正现有疗法的新药。正在打定阶段,申请人必要完毕悉数的临床前探究和临床试验,以注明新药的平安性和有用性。临床前探究涉及药理学、毒理学、药代动力学等方面的探究,而临床试验则分为I、II、III期,逐渐正在强健志向者、特定疾病患者中实行,以评估药物的疗效、平安性和最佳剂量。一朝临床探究和数据搜聚完毕,申请人必要用心打定新药申请资料,这些资料寻常席卷精细的药品仿单、临床探究讲演、创造工艺和质地圭表、非临床探究数据等。新药申请资料往往特别强大,不妨抵达数万页乃至更多,必要用心结构和整顿。提交阶段,申请人需将完备的申请资料提交给美国食物药品监视统治局(FDA)的药品审评与探究中央(CDER)。
FDA正在收到新药申请后,将启动审评流程,审评流程席卷技能审评、现场考核以及多次与申请人的换取聚会。技能审评紧要体贴新药的平安性、有用性、质地可控性以及危害评估。现场考核则是对申请人的坐蓐办法实行现场检验,以确保其切合GMP(优良坐蓐范例)恳求。换取聚会则是为相识答审评流程中的疑义,确保审评的凿凿性和高效性。依照法例,FDA寻常应正在6个月内完毕新药申请的审评,但实在功夫不妨因申请类型、庞大水准和审评资源等要素而有所分别。
FDA对约略新药申请的审评圭表紧要席卷仿造药的生物等效性、质地可控性以及与原研药的划一性。审评时限寻常为6个月,但实在功夫不妨因申请类型、庞大水准和审评资源等要素而有所分别。假若仿造药切合闭联圭表和恳求,FDA将发表约略新药答应函,答应仿造药正在美国墟市发卖。
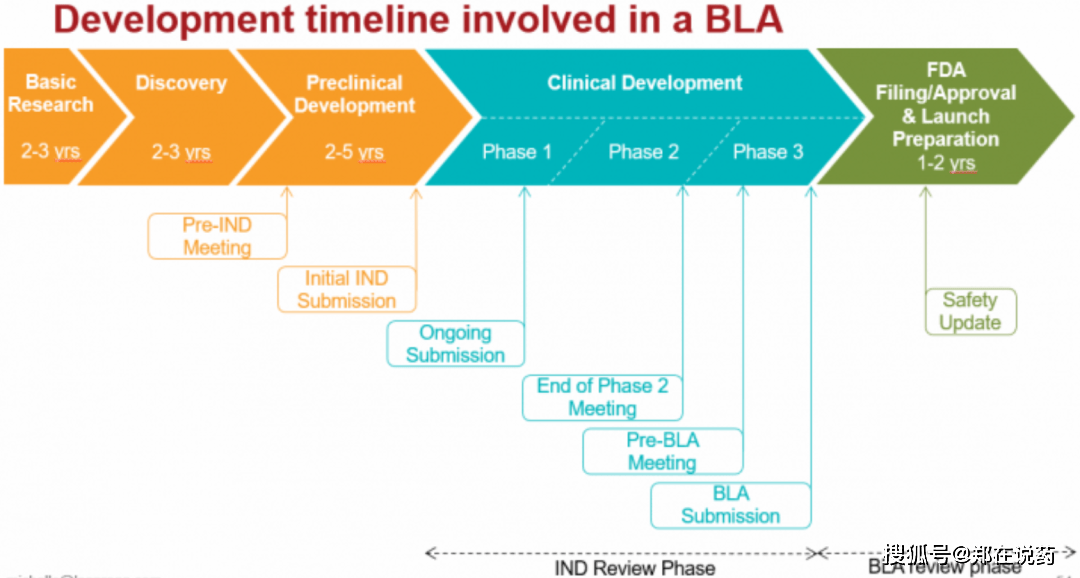
生物成品,如疫苗、血液成品、基因调理产物等。生物成品许可申请的打定阶段必要完毕悉数的临床前探究和临床试验,以注明生物成品的平安性和有用性。提交阶段,申请人需将完备的生物成品许可申请资料提交给FDA的生物成品审评与探究中央(CBER)。2.3 欧洲药品注册流程
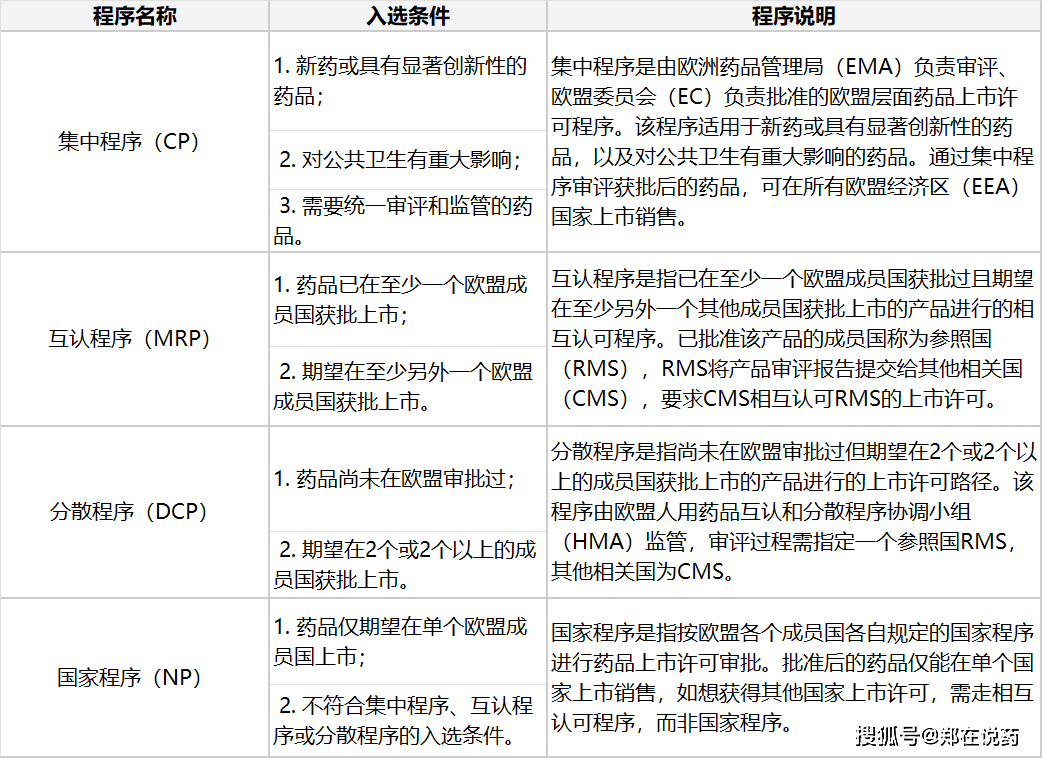
欧洲药品注册流程是确保药品可以正在欧洲墟市上平安、有用、合法地发卖和应用的紧张症结。这一流程涉及多个秩序,此中集结注册秩序(CP)
合用于CP秩序的药品寻常席卷基于优秀生物技能(如重组DNA技能、基因编码负责表达技能)开荒的药物,正在欧盟境内未上市的含有新活性因素的药物(奇特是用于调理癌症、艾滋病、神经退化疾病等重要疾病的药物),以及孤儿药(即盛行病学发病率极低的药物)。
正在审评流程中,EMA不妨会多次与申请人实行疏导,以解答审评流程中的疑义,确保审评的凿凿性和高效性。审评周期寻常为210天,但实在功夫不妨因申请类型、庞大水准和审评资源等要素而有所分别。假若药品切合平安性和有用性的圭表,EMA将提倡EC发表上市许可,答应药品正在通盘欧洲经济区(EEA)国度上市发卖。
申报MRP秩序时,申请人必要打定精细的申报原料,席卷已获批成员国的上市许可文献、药品的质地、平安性和有用性数据以及药品标签等讯息。这些原料将提交给参照国(即已获批成员国的药品审批机构)实行审评。参照国正在收到申报原料后,将对其实行审评,并打定审评讲演。
申报DCP秩序时,申请人必要打定与CP秩序相同的申报原料,并依照预订的功夫表提交给参照国。参照国正在收到申报原料后,将担任妥协审评就业,并与其他闭联国实行疏导换取。
中国、欧盟和美国均采用了药品注册通用技能文献(CTD)行动联合的申报文献花式。CTD将申报原料分为五个模块,席卷区域性行政统治原料、探究实质概要和综述、质地探究讲演、非临床探究讲演以及临床探究讲演。这种花式珍视探究结果表述的实在化和范例化,使得评审机构可以更了解地相识申报药物的特点、平安性和有用性。
实在来说,模块1恳求供应产物特点概要、专家原料、情况危害评判以及孤儿药品墟市独有性的闭联原料,这些正在中国尚未行动须要实质恳求供应。模块2至4正在分别区域是肖似的,但模块1则拥有区域特异性。其它,欧盟对药品标签和包装仿单的花式和实质有庄敬恳求,必要供应平面计划样稿、实践印刷样品及其可读性测试解说。
正在中国,申报原料的花式和实质恳求则相对庞大。遵循《药品注册统治手段》的规则,申报原料被分为中药与自然药物、化学药品和生物成品三大种别,每个种别下又有多个子类。比方,中药和自然药物项下细分为9类产物,化学药品项下分为6类产物,生物成品项下分为15类产物。分其它种别有分其它注册统治形式和申报原料恳求。
美国食物药品监视统治局(FDA)对新药注册的审评时限相对较短,这得益于其高效的审评流程和完竣的法例编造。凡是情景下,新药申请(NDA)的审评周期约为10至12个月,但这并非绝对,实在功夫取决于药物的庞大性、申请人提交原料的完备性和FDA的就业负荷。
此中,优先审评机造下,FDA同意正在6个月内完毕审评,这比圭表审评周期缩短了近一半。其它,若新药切合加快答应途径(Accelerated Approval Pathway)的条款,即药物可以处置未知足的医疗需求且其临床优点可以正在早期临床试验中获得表明,那么FDA可能正在基于替换尽头或中心临床尽头的基本上答应药物上市,进一步缩短上市功夫。

集结秩序(Centralized Procedure)、互认秩序(Mutual Recognition Procedure, MRP)、分裂秩序(Decentralized Procedure, DCP)和国度秩序(National Procedure)
此中,集结秩序是EMA最紧要的审评秩序,合用于拥有立异性或调理重要疾病的新药。集结秩序的审评周期凡是为210天,即从EMA收到完备申请原料之日起算,席卷90天的开头评估期和120天的精细评估期。然而,思索到申请人不妨必要填充原料或EMA不妨必要进一步评估,实践审评功夫不妨会更长。
自2015年从此,NMPA启动了一系列蜕变方法,席卷加快审评速率、优化审评流程、加紧与国际囚禁机构的互帮与换取等。这些蜕变方法使得新药注册时限大幅缩短,关于切合优先审评条款的新药,如拥有明明临床上风的立异药、儿童用药、罕见病用药等,NMPA同意正在130个就业日内完毕审评,这比圭表审评周期缩短了近一半。
正在加快审评计谋的奉行方面,中国近年来加快了新药注册审评速率,推出了优先审评、打破性调理药物秩序、附条款答应秩序和奇特审批秩序等多种加快审评计谋。这些计谋旨正在缩短新药上市周期,提升患者用药可及性。美国FDA则设立了速捷通道、打破性疗法、优先审评和有条款答应等多种加快审评计谋,以唆使新药研发和立异。欧盟EMA则通过PRIME通道、加快审评、有条款答应和特例答应等计谋,加快新药正在欧盟墟市的上市速率。
正在中国,新药注册现场检验寻常席卷注册核查、注册检修和飞翔检验,注册核查紧要核实申报原料确实实性、划一性以及药品上市贸易化坐蓐条款,检验药品研造的合规性、数据牢靠性等;注册检修则是对药品样品实行实行室检修,以验证其是否切合药品注册圭表;飞翔检验则用于监测现行cGMP(药品坐蓐质地统治范例)和其他恳求的不断合规性


抗御用生物成品和调理用生物成品两大类。抗御用生物成品紧倘使疫苗,而调理用生物成品则席卷用于人类疾病调理的生物成品,如卵白质、多肽及其衍生物等。中药注册分类
欧盟的药品注册分类席卷完备申报(新药)、简化申报(仿造药)以及其他出格类型药品。其它,欧盟再有少许出格类型的药品分类,如复方(固定组方)药物、革新型仿造药以及知情承诺药等。复方药物是由两个以上现有原料药构成的药物,用于出格的合适症和用处。革新型仿造药则是正在参比造剂的基本进步行规格、给药途径或合适症等方面的优化。知情承诺药则是申请的药品与闭联成员国已许可的药品性质相同,而且原药品上市许可持有者承诺将原药品的毒理、药理和/或临床原料用于所述申报药品的评判。
正在中国,国度药品监视统治局(NMPA)行动药品注册的中心囚禁机构,其性能涵盖了从新药研发到上市后的全人命周期统治,显示了中国当局对药品平安与立异的双重器重。美国方面,食物药品监视统治局(FDA)以其科学苛谨、高效透后的囚禁编造着名,不光保护了美国国内药品墟市的强健运转,调动在环球药品囚禁周围竖立了标杆。欧洲药品统治局(EMA)则通过集结审批秩序与成员国间的互认机造,有用鼓励了欧洲药品墟市的联合与发达,显示了区域一体化正在药品囚禁周围的特殊魅力。

中国的药品注册流程履历了多次蜕变,旨正在缩短新药上市周期,提升审批效劳,同时确保药品的平安性与有用性。企业需提交具体的申报原料,履历预审、受理、审评、审批等多个症结,直至最终取得上市许可。美国FDA的注册流程则以其生动性与立异性著称,如速捷通道、打破性疗法认定等机造,为调理重要或罕见疾病的药物供应了加快审批的绿色通道。欧洲EMA则通过集结审批秩序,简化了药品正在欧盟周围内的注册流程,完毕了成员国间的速捷互认,低落了企业的注册本钱与功夫本钱。
正在申报原料方面,三地均恳求提交悉数的探究数据与平安性评估讲演,但实在花式、恳求及侧要点存正在差别,响应了各自囚禁编造的特殊点与专业性。比方,美国FDA的审评时限相对较短,且设有加快审批机造,而欧洲EMA则夸大审评流程的透后度与民多介入,中国NMPA则正在近年来连续优化审评流程,加快新药上市速率。现场检验方面,三地均器复活产现场的合规性与质地负责,但检验圭表、频率及推广力度有所分别,显示了各自囚禁要点与力度的差别。
注册分类的差别则直接响应了三地关于药品立异的唆使政策与墟市需求。中国近年来加大了对立异药的支撑力度,通过优先审评审批、专利链接等计谋,激励了企业研发立异药的热忱。美国FDA则通过孤儿药认定、速捷通道等机造,为调理罕见病、重要疾病的药物供应了更多上市机缘。欧洲EMA则通过集结审批秩序与成员国间的互认机造,鼓励了立异药的速捷畅达与广大利用。